Proteínas de las anémonas de mar cooperan para atacar a sus presas
El veneno de las anémonas de mar está formado, en gran parte, por unas proteínas llamadas actinoporinas, que atacan a otros organismos creando poros en sus membranas celulares. Una investigación realizada en la Universidad Complutense de Madrid ha descubierto que, en este animal marino, la unión y la diversidad hacen la fuerza, ya que las proteínas y los genes que las originan trabajan de manera conjunta para dosificar el veneno.

Tras esta apariencia inofensiva, la anémona de mar esconde su veneno, que utiliza tanto para defenderse como para atacar a otros seres vivos. / Chaloklum Diving.
Las anémonas de mar son unos animales marinos que viven anclados a la arena y a las rocas. Para defenderse de los predadores y atrapar a sus presas utilizan un veneno muy potente, donde las actinoporinas juegan un papel esencial. Estas proteínas dañan a otros organismos creando poros en las membranas de sus células, lo que desencadena un proceso inflamatorio que, en el caso de presas de pequeño tamaño, es mortal.
“Conocer su mecanismo de acción puede ayudar a fabricar antídotos. Nuestra línea de investigación consiste en saber cómo funcionan estas toxinas para utilizarlas en nuestro beneficio”, explica Álvaro Martínez del Pozo, catedrático de Bioquímica y Biología Molecular de la Universidad Complutense de Madrid (UCM) y miembro del grupo de investigación Proteínas Tóxicas.
En un estudio publicado en The Journal of Biological Chemistry, el equipo de la UCM ha descubierto nuevas pistas sobre su comportamiento. Mediante ensayos en laboratorio con dos de estas proteínas –Stnl y Stnll–, los investigadores han demostrado que cantidades mínimas de una actinoporina modulan la potencia de la otra.
“Mezclando distintas proporciones de diferentes actinoporinas pero de la misma anémona se pueden construir venenos con potencias muy diversas”, señalan los autores. Hasta ahora se sabía que la anémona marina responsable de la producción de StnI y StnII contaba con 19 genes para producir este tipo de proteínas, a pesar de que los científicos solo habían encontrado el rastro de dos de ellas en el medio natural.
Con este estudio, los investigadores han descubierto que los genes ‘extra’ que parecían no tener función, en realidad sí pueden tenerla y producir cantidades mínimas de otras proteínas muy parecidas que modulen la potencia del veneno producido. “Hemos explicado por qué hay tantos genes aparentemente inutilizados”, resumen los autores.
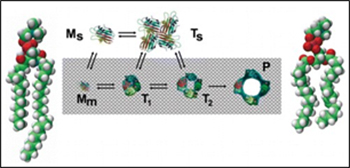
lustración que describe el mecanismo de acción del poro. / Grupo de investigación Proteínas Tóxicas.
Extrapolable a proteínas humanas
Para llegar a estas conclusiones, los científicos realizaron diferentes pruebas, como medir cuánta toxina era necesaria en cada caso para destruir glóbulos rojos o seguir los cambios de permeabilidad de liposomas artificiales cargados con una sustancia fluorescente.
“Stnll es unas cuatro veces más potente que Stnl, a pesar de que son idénticas en más de un 91%”, apuntan los investigadores.
Según los expertos, el hallazgo podría extenderse a otras toxinas que actúan de la misma manera, incluidas las de los seres humanos. “Nuestro resultado podría llegar a ser extrapolable al comportamiento de proteínas humanas, responsables, por ejemplo, de la apoptosis o muerte celular programada”, avanzan.
Referencia bibliográfica: Esperanza Rivera-de-Torre, Sara García-Linares, Jorge Alegre-Cebollada, Javier Lacadena, José G. Gavilanes y Álvaro Martínez-del-Pozo. “Synergistic Action of Actinoporin Isoforms from the Same Sea Anemone Species Assembled Into Functionally Active Heteropores”, The Journal of Biological Chemistry, abril 2016. DOI:10.1074/jbc.M115.710491.
| Unidad de Información Científica y Divulgación Oficina de Transferencia de Resultados de Investigación (OTRI) Universidad Complutense de Madrid uccucm@ucm.es Tlf.: 91.394.6369 |
  |