Persiguiendo la conversión de venenos en tratamientos mediante la comprensión de la metamorfosis de las actinoporinas
Las actinoporinas son proteínas tóxicas producidas por anémonas marinas. Su toxicidad se explica porque sufren una metamorfosis molecular que les permite integrarse en la membrana de las células y matarlas mediante la producción de poros. Literalmente, perforan las membranas. Desde el “Grupo de proteínas Tóxicas” de la UCM se busca comprender su mecanismo de acción para así poder utilizarlas con fines terapéuticos. Recientemente se han dado pasos clave hacia dicha comprensión, al nivel molecular más básico. Un conjunto de resultados que acaba de recogerse en forma de dos artículos publicados en la revista ACS Biochemistry.
Es muy frecuente que los organismos que viven inmóviles recurran a la producción de potentes venenos, tanto para defenderse, como para cazar las presas de las que se alimentan. Estos venenos suelen ser mezclas complejas de moléculas, incluidas diversas proteínas con muy variadas funciones. Entre estas proteínas destacan las neurotóxicas y aquéllas que destruyen las membranas de las células. Las primeras suelen ser responsables del dolor que sentimos cuando uno de estos animales nos inocula su veneno, y las segundas son las que causan la inflamación que solemos padecer.
El “Grupo de Proteínas Tóxicas” de la Universidad Complutense lleva más de dos décadas dedicado al estudio de una familia de proteínas que destruyen las membranas mediante la producción de poros, a través de los cuales las células pierden parte de su contenido y acaban destruyéndose por un choque osmótico. Estas proteínas son producidas por anémonas marinas venenosas y, por ello, se conocen con el nombre de actinoporinas. Actino de Actinia (un tipo de anémonas) y porinas de formadoras de poros.
Es de conocimiento generalizado que el aceite no se mezcla con el agua, el principal componente de un ser humano. Se estima que el 70% en peso de una persona es, simplemente, agua; agua con sal, más concretamente. Por eso, la mayoría de las proteínas que circulan por nuestros fluidos, o las que funcionan en el interior de las células, son solubles en agua. No “hacen buenas migas” con los lípidos, la parte grasa de nuestros cuerpos. Sin embargo, existe otro tipo de proteínas que, muy al contrario, lo que necesitan es formar parte de las membranas de las células para llevar a cabo su función adecuadamente. Suelen ser proteínas que exponen regiones que “no se llevan bien con el agua”. Precisamente por este motivo se refugian en la parte hidrofóbica (fobia por el agua) de las membranas celulares. Esto explica que ya en cualquier libro de Bioquímica básica se hable de proteínas solubles y de membrana como de dos grupos irreconciliables funcional y estructuralmente hablando.
Las actinoporinas, sin embargo, escapan a esta clasificación tan simple. Las anémonas las producen en su forma soluble y, de hecho, se reparten “alegre y felizmente” en el agua. No sólo el agua del mar, sino también la de los fluidos de sus presas y predadores, humanos incluidos. Sin embargo, cuando se encuentran con la membrana de una célula sufren una drástica metamorfosis que las transforma entonces en proteínas de membrana, con la consecuente formación de poros. La célula afectada resulta herida de muerte y, en pocos minutos, desaparece por el mencionado choque osmótico.
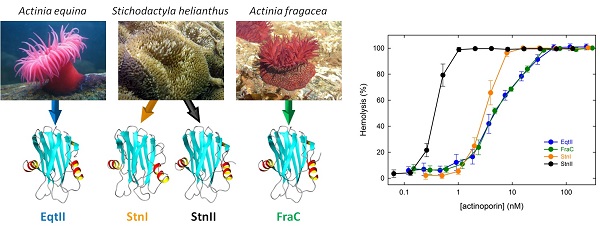
Por todo ello, estas proteínas suponen un modelo óptimo para estudiar esta transición de una proteína desde el agua a la membrana. Un problema termodinámico, de química elemental, pero de muy difícil resolución y comprensión. El grupo de la Complutense, en colaboración con un laboratorio de la Universidad Åbo (Turku, Finlandia), ha llevado a cabo un detallado estudio del papel de un grupo de aminoácidos (las moléculas que forman las proteínas) que son clave para explicar por qué una proteína puede integrarse en una membrana: los triptófanos. Los resultados, publicados en la revista ACS Biochemistry, permiten ahora asignar papeles individuales a cada uno de los mencionados triptófanos y contribuyen a expandir nuestra comprensión del mecanismo de acción de estas toxinas. Simultáneamente, y ahora sumándose también a esta colaboración un grupo de la Universidad de Tokio, se ha podido determinar cuáles son las pequeñas diferencias estructurales que justifican las distinta capacidad tóxica de las pocas actinoporinas que hasta ahora se conocen con suficiente detalle. Dicho de otra forma, se ha diseccionado su diferente capacidad de formación del poro; otro conjunto de resultados que también se ha publicado en la revista ACS Biochemistry.
Estos avances en el conocimiento detallado del mecanismo de acción de estas proteínas tan singulares no sólo aportan luz a la comprensión del fenómeno general del plegamiento de proteínas en ambientes tan diferentes como el del agua o el de una membrana biológica, sino que permiten avanzar hacia su potencial utilización terapéutica. Al fin y al cabo, el fin último de esta línea de investigación no es sino acabar consiguiendo convertir venenos en tratamientos.
Referencias:
S. García-Linares, T. Maula, E. Rivera-de-Torre, J.G. Gavilanes, J.P. Slotte y A. Martínez-del-Pozo (2016) “Role of the tryptophan residues in the specific interaction with biological membranes of the sea anemone actinoporin StnII from Stichodactyla helianthus” ACS Biochemistry 55 (46), 6406−6420. DOI: 10.1021/acs.biochem.6b00935.
S. García–Linares, E. Rivera–de–Torre, K. Morante, K. Tsumoto, J.M.M. Caaveiro, J.G. Gavilanes, J.P. Slotte, Á. Martínez-del-Pozo (2016) “Differential effect of membrane composition on the pore–forming behavior of four different sea anemone actinoporins”. ACS Biochemistry (en prensa). DOI: 10.1021/acs.biochem.6b01007.
Autores: Sara García Linares, Esperanza Rivera de Torre, Juan Palacios Ortega y Álvaro Martínez del Pozo
| Unidad de Información Científica y Divulgación Oficina de Transferencia de Resultados de Investigación (OTRI) Universidad Complutense de Madrid uccucm@ucm.es Tlf.: 91.394.6369 |
  |